La Unión Internacional de Química Pura y Aplicada (IUPAC por sus siglas en inglés), considera como nanopartículas todas aquellas partículas en el rango de 1 x 10-9 hasta 1 x 10-7 m, mientras que la agencia de protección al ambiente de Estados Unidos (EPA, por sus siglas en inglés) las dividió en cuatro grandes grupos dependiendo de su diámetro: ultrafinas (Ø ≤ 100 nm = 0.1μm), finas (0.1μm < Ø ≤ 2.5μm), gruesas (2.5μm < Ø ≤ 10μm) y extragruesas (Ø >10μm). La importancia de esta distinción radica en que las propiedades físicas y químicas de los materiales comienzan a cambiar por debajo de los 100 nm. Su área superficial, reactividad, propiedades de transporte, dispersión, propiedades ópticas, entre otras, así como la ruta de síntesis y materiales empleados en su fabricación, las hace deseables en áreas como energía, medicina, farmacéutica, nanobiotecnología, nanosistemas, ingeniería óptica, seguridad y defensa, bioingeniería, cosmética, electrónica, textiles, entre otras industrias. Existen muchas y muy variadas técnicas de síntesis de nanopartículas, las cuales se han dividido en dos grandes grupos: métodos “top down” y métodos “bottom up”. La diferencia radica en si las nanopartículas se obtienen de una fracción más grande del material (“top down”) o por el contrario mediante la síntesis de compuestos o moléculas que dan origen a partículas de mayor tamaño (“bottom up”).
Para aplicaciones en biomedicina, la IUPAC hace una distinción entre las nanopartículas y los materiales liberadores de fármacos (nanoacarreadores), agrupándolos como nanopartículas, micelas y liposomas, pudiendo ser estos últimos de nanómetros o micrométros en diámetro. En este sentido, las nanopartículas son consideradas moléculas rígidas, orgánicas o no, mientras que las micelas y liposomas son moléculas orgánicas suaves. El empleo de nanoacarreadores para aplicaciones en seres vivos, incluyendo al humano, involucra tanto su biocompatibilidad, biodegradabilidad e inocuidad a diversos niveles, además de la determinación de la dosis a emplear, la ruta de administración, efectos secundarios, vida media del fármaco o biomolécula acarreada, farmacocinética, entre otros, tal que el sistema de liberación del fármaco o biomolécula sea más efectivo y seguro.
En el grupo de Nanomateriales y sus efectos tóxicos, integrado por investigadores y estudiantes de la Facultad de Ciencias Físico-Matemáticas de la Benemérita Universidad Autónoma de Puebla, Instituto de Medicina Forense de la Universidad Veracruzana, División de Ciencias Básicas e Ingeniería de la Universidad Autónoma Metropolitana Unidad Azcapotzalco y Departamento de Genética y Biología Molecular de CINVESTAV-IPN, hemos unido esfuerzos para fabricar y caracterizar diversos tipos de nanoestructuras con aplicaciones biomédicas mediante diversas técnicas de fabricación “bottom up”, entre ellas la microfluídica.

Los sistemas microfluídicos se basan en la tecnología desarrollada desde la década de 1950 para los circuitos integrados, y de su integración en sistemas más complejos durante los años 80’s, capaces de realizar una función específica. Dichos sistemas, entre 10 y 1000 micras de tamaño, recibieron el nombre de “Sistemas Micro-Electro-Mecánicos (MEMS, Micro Electromechanical Systems). Ya hacia finales de los años 90’s fueron desarrollados los sistemas Laboratorio en un Chip (LOC, Lab on a Chip), cuya base fue utilizar principios de análisis químico, biológico, médico, bioquímico y biotecnológico escalables, y donde el uso de reactivos es mínimo. De esta forma se planteó realizar investigación de laboratorio en un dispositivo de unos cuantos milímetros a pocos centímetros de área, con la capacidad de realizar múltiples funciones como la selección de proteínas en procesos diversos, ingeniería metabólica, estudio y desarrollo de fármacos, micro y nanoacarreadores, entre otros.
Dependiendo del uso final del dispositivo LOC, existen varios métodos de fabricación que pueden variar desde la producción industrial en serie, a prototipos rápidos a nivel de laboratorio de investigación. Los principales métodos de fabricación incluyen la fotolitografía de silicio y vidrio, y moldeado y maquinado de polímeros. La fotolitografía se explota debido a su fidelidad en dimensiones micro y nanométricas, así como su estabilidad superficial y compatibilidad con diversos solventes. En el moldeado y maquinado generalmente se emplean polímeros, como poliestireno, policarbonato, policloruro de vinilo, copolímero de olefina cíclica (COC) y especialmente poli (metil metacrilato). Esta técnica de fabricación permite la creación rápida de prototipos dado que son más baratos, robustos y generalmente con procesos de fabricación más económicos que en vidrio o silicio.
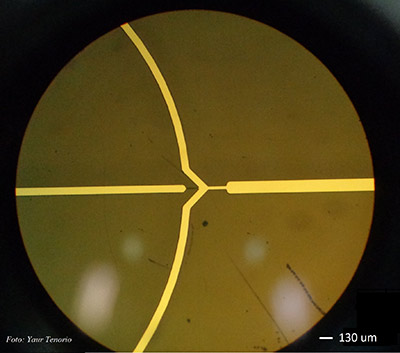
Independientemente del método de fabricación, la funcionalidad de los sistemas LOC está fuertemente determinada por el comportamiento de los fluidos en la microescala (10-9 a 10-18 litros). De allí que a la ciencia y tecnología que manipulan a los fluidos en canales de unos cuantos micrómetros se le conoce como microfluídica, la cual ha encontrado diversas aplicaciones tanto para el diagnóstico y monitoreo en tiempo real como para la fabricación de nanoacarreadores de diversas biomoléculas, incluidos fármacos. George M. Whitesides fue quien inicialmente desarrolló la tecnología basada en microfluídica a través del empleo de canales, válvulas, mezcladores y bombas de decenas o cientos de micrómetros, fabricados dentro de una celda e inyectados a través de bombas de infusión. Las primeras aplicaciones de la microfluídica se orientaron al análisis dado que ofrecen la posibilidad de emplear bajos volúmenes de reactivos durante las separaciones y detección de diversas muestras, con gran resolución y sensibilidad a bajos costos y tiempos cortos de reacción. La microfluídica, como técnica de síntesis de nanoestructuras, permite la generación de micro y nanopartículas con muy baja dispersión, pudiendo ser funcionalizadas y bioconjugadas dentro o fuera del dispositivo microfluídico.
En los canales microfluídicos se explota el fenómeno del flujo laminar, donde la fuerza de inercia es menor que la fuerza viscosa de los fluidos. Esto provoca que dos líquidos se mezclen solo debido a la difusión de las moléculas en la interfaz entre los líquidos en contacto dentro del microcanal, haciendo necesario el desarrollo de geometrías específicas para promover el mezclado de los líquidos. Debido a esto, para la fabricación de celdas microfluídicas de propósito específico se tiene que considerar la densidad y viscosidad de los fluidos, el diámetro hidráulico del microcanal y la velocidad de inyección de los fluidos. La inyección simultánea de diversos fluidos es otra ventaja de la técnica, ya que se pueden generar y manipular burbujas y gotas mono dispersas dentro de una fase continua de flujo.