Al subirnos o al manejar un automóvil, pensamos que son piezas de ingeniería muy avanzadas. Lo que usualmente más nos llama la atención es su potencia, su velocidad y todos los accesorios que pueda tener, como el GPS, sensores, cámaras, reproductor de música, etcétera. Sin embargo, detrás de todo este gran desarrollo tecnológico hay una ciencia que generalmente no asociamos a la industria automotriz: la química. Y es que en un coche hay mucha química, tanto en su elaboración como en su funcionamiento rutinario o incluso en algunos sistemas de seguridad que han salvado incontables vidas. El ejemplo más evidente es el de las baterías, que funcionan básicamente como muchas pilas, llevando a cabo reacciones electroquímicas de oxidación y reducción. Pero además de esta característica bastante sabida, me gustaría contar algunas cosas no tan conocidas pero fundamentales en este medio de transporte tan recurrido.
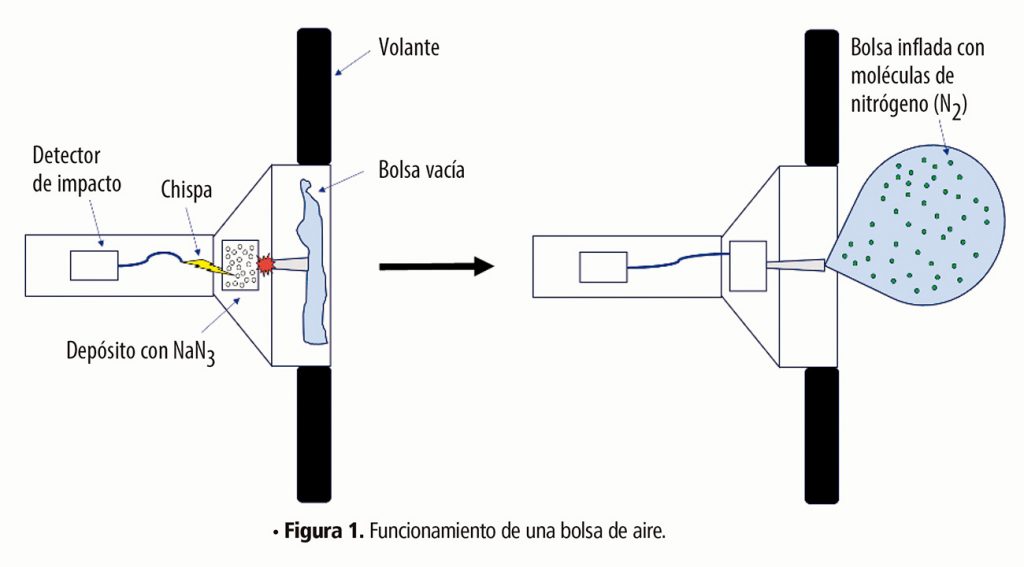
- Bolsas de aire (airbag). La lógica de este sistema es muy simple; básicamente es una bolsa que se infla y genera una especie de “almohada”, impidiendo que el pasajero golpee su cabeza contra el parabrisas, el volante o cualquier otro elemento que le pueda causar daño. El principio es simple, pero hay un factor fundamental para que esto funcione: el tiempo. La bolsa se tiene que inflar en un tiempo menor del que tarda en llegar la persona al volante, y esto, en un choque, toma solo una fracción de segundo. Por tanto, la opción de que el coche contenga un tanque con el gas requerido, y que este se abra rápidamente para llenar la bolsa, no es factible. Este problema fue entonces resuelto por la química, ya que en lugar de proveer al automóvil de un tanque con un gas presurizado (peligroso), se incorpora un sistema que porta una sustancia química que, al hacer una reacción, genera una cantidad suficiente de nitrógeno para inflar la “almohada”.
La reacción en cuestión utiliza un reactivo llamado azida de sodio (NaN3), y es un sólido blanco relativamente estable, salvo que se someta a altas temperaturas, situación en la cual se descompone de manera violenta, generando muy rápidamente moléculas de nitrógeno (N2) el cual es un gas no tóxico.
Podemos deducir algunas ventajas y desventajas de esta reacción química: la primera ventaja es que no se requiere transportar un tanque de gas en el vehículo, además de que se necesitan sólo 60 gramos de azida de sodio (NaN3) para generar aproximadamente 30 litros de nitrógeno, suficiente para llenar la bolsa. Otra ventaja es que este sólido permanecerá en ese estado salvo que se le aplique una temperatura bastante alta, de más de 275 °C. Esto se traduce en que salvo que calentemos la azida de sodio a esa temperatura, nuestro coche no explotará espontáneamente, pero una vez alcanzada esta temperatura, la reacción se produce de la forma más rápida que se conoce: mediante una explosión. No nos asustemos, la explosión de 60 gramos de azida de sodio, generando un gas no inflamable como el nitrógeno, es controlable y no representa ningún riesgo, sino todo lo contrario, ya que llenará la bolsa de aire en solo 30 a 40 milésimas de segundo, antes de que la cabeza de la persona golpee el volante o el tablero.
La ventaja de que la reacción se produzca a altas temperaturas también conlleva un problema, ya que seguramente se estén preguntado ¿y entonces cómo se hace para calentar rápidamente el depósito del reactivo a la temperatura requerida? Afortunadamente la energía requerida no es tan alta y no es necesario un relámpago de 1.21 gigawatts,1 sino una descarga eléctrica más leve. Los coches contienen unos sensores que, al haber un cambio muy brusco de la velocidad, cierran un circuito y producen la chispa necesaria para desencadenar la explosión, la cual, como ya se mencionó, libera una cantidad suficiente de gas nitrógeno (N2) e infla la bolsa (Figura 1).
- Batería. En el último aliento del siglo XVIII2 el químico italiano Alessandro Volta realizó la invención de un artefacto que es vital para el funcionamiento de muchos aparatos eléctricos hoy en día. Aunque se han hecho modificaciones para hacer más eficiente la pila original de Volta, que utilizaba zinc (Zn) y cobre (Cu), el principio sigue siendo el mismo; se basa en reacciones químicas de oxidación y reducción.3 Empecemos por definir qué son estas reacciones, recordando que los átomos están esencialmente compuestos de protones (y neutrones) en el núcleo y de electrones alrededor.
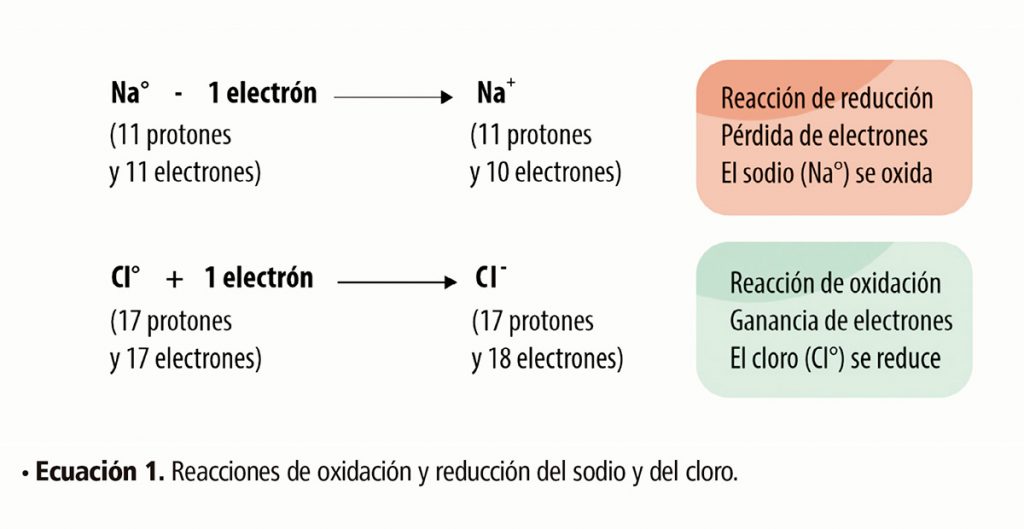
Una reacción de oxidación implica la pérdida de electrones por parte de un átomo y una reducción implica la ganancia de electrones.4 En principio, todos los átomos son capaces de hacer estas reacciones, sólo que a algunos les cuesta más que a otros, pero los que hacen muy bien esto son los metales. Ahora bien, supongamos que el metal tenía tres protones (carga positiva) y tres electrones (carga negativa) en su estado neutro, y al perder un electrón, quedó con tres protones y dos electrones. Si hacemos la diferencia, nos queda un valor de +1, que es la carga que se le asigna a la nueva especie. Inversamente, si hay un electrón de más, el valor será de -1. En la ecuación 1 se muestra este proceso tomando al sodio (Na) y al cloro (Cl) como ejemplos.5
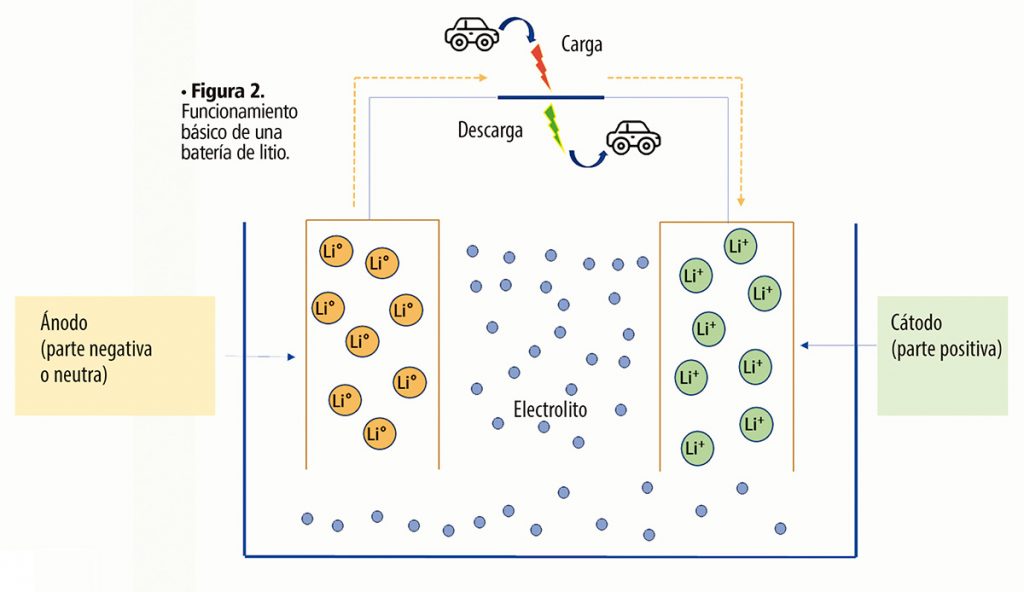
Ahora bien, en una batería, se colocan átomos que pueden dar electrones y otros que pueden aceptarlos, y cuando estos electrones van de un punto a otro, pueden ser aprovechados para generar electricidad. Así, los elementos básicos de una batería son el cátodo (parte positiva), el ánodo (parte negativa) y el electrolito (solución conductora). Como se mencionó antes, existen diferentes tipos de baterías, que emplean distintos metales, pero tal vez lo más simple es explicarlo con el litio, ya que estas son unas de las más versátiles, eficientes y utilizadas hoy en día.
Como se puede ver en la figura 2, en el ánodo se encuentra el Li° (neutro) con 3 protones y 3 electrones, y en el cátodo (positivo) está el Li+, con 3 protones y sólo 2 electrones. Así, los electrones pasarán del ánodo al cátodo para que el Li+ “recupere” su electrón faltante, pero en este paso, es posible “interceptar” a los electrones y tener corriente eléctrica (descarga hacia el coche). En este proceso, los átomos de Li° se oxidan, transformándose en Li+. Ahora bien, ¿cómo se recuperan los electrones que ya se utilizaron en forma de corriente eléctrica? Afortunadamente, el movimiento de las ruedas del motor puede después proporcionar electrones al sistema, recargando la batería. En muchos autos eléctricos, esta carga también se puede hacer conectándolo a un enchufe.
- Pinturas. Aunque la pintura no interviene propiamente en el funcionamiento de los autos, sí tiene que ver con la protección a la corrosión y al ambiente, con la estética o disminuir la fricción. Más interesante aún, en el proceso de pintado intervienen también reacciones químicas.
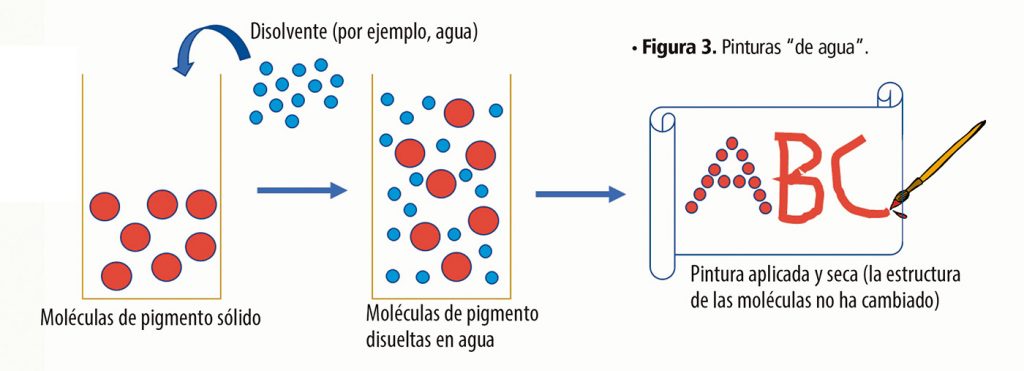
No es ningún secreto que los pigmentos son moléculas de diferente tipo; algunas son estructuras orgánicas (Carbono e Hidrógeno, principalmente) y otras son organometálicas (estructuras orgánicas con algún átomo metálico). Algunas de estas estructuras son solubles en agua y pueden ser disueltas para después ser aplicadas en alguna superficie que las absorbe, por ejemplo, las acuarelas o algunos colorantes textiles. En estos casos, el agua sólo sirve de medio de transporte para las moléculas de colorante, y su durabilidad depende de qué tan fuertemente se adhieran a la nueva superficie, pero es importante mencionar que en estos casos no hay un cambio en la estructura de los pigmentos. Es la misma antes y después de ser aplicada (Figura 3).
Por otro lado, las pinturas llamadas epóxicas, acrílicas, vinílicas, etcétera6, se componen de varios elementos, pero nos podemos centrar sólo en dos componentes esenciales. Uno de estos, por supuesto, es el pigmento; es decir, las moléculas que proporcionan el color, pero, además, se incorporan algunas moléculas de un monómero. Estas moléculas de monómero se unen entre ellas por la acción de otro reactivo o en algunos casos, por el oxígeno del aire, formando cadenas muy largas de una molécula que químicamente, ya no tiene la misma estructura que al inicio. Es decir, en el proceso de secado, ocurrió una reacción química y, a diferencia de las acuarelas, la estructura química de la pintura cambió después del secado y el endurecimiento (Figura 4).
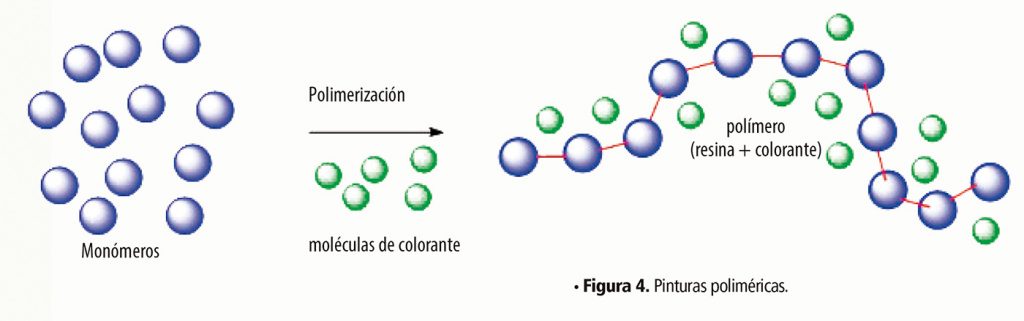
Además de los dos elementos básicos mencionados, las pinturas automotrices incluyen diversos aditivos que modifican o mejoran la calidad, resistencia, acabado, etcétera, pero el principio de polimerización se aplica en general, dando lugar a una especie de cubierta plástica que resiste muy bien las condiciones ambientales y le da al auto un aspecto impecable.
Así como este último, hay varios ejemplos más en los que la química interviene, ya sea en la fabricación o en el funcionamiento de los automóviles y otros vehículos. Procesos como la polimerización, la combustión o la lubricación, están presentes en los coches y la explicación está básicamente ligada a la química, pero aquí quise solamente resaltar algunos de los menos conocidos.
En resumen, como pudimos ver, tanto en la fabricación como en el funcionamiento diario de un automóvil intervienen varios procesos químicos. Evidentemente, por cuestión de espacio, no hemos hablado de todos, pero con estos ejemplos nos podemos dar una idea de la cantidad de cosas en las que interviene la química en nuestro día a día.
Alejandro Cordero Vargas es investigador en el departamento de química orgánica del Instituto de Química de la UNAM. Su principal línea de investigación es la síntesis orgánica, con especial interés en los radicales libres.
1 Es imposible no recordar los 1.21 giga Watts que requerían Marty McFly y Emmet Brown para que funcionara su coche en “Volver al Futuro”. Ellos sí requerían de un relámpago.
2 La invención fue hecha en 1799.
3 También se les conoce como reacciones de óxido-reducción o reacciones Redox.
4 Es necesario hacer una aclaración sobre la terminología, que puede ser confusa: la reacción en la que se pierde un electrón, se llama oxidación, el átomo o molécula que lo pierde se oxida, pero el átomo que gana ese electrón se reduce. Como en estos procesos, los electrones pasan de un átomo a otro, forzosamente uno se reduce y otro se oxida.
5 Curiosamente, el sodio elemental y neutro (Na°) es muy reactivo y peligroso. El cloro en gas (Cl2, también neutro) es muy tóxico, pero después de hacer las correspondientes reacciones de óxido-reducción, se transforman en iones que, unidos forman un compuesto muy inocuo: el cloruro de sodio (NaCl) o sal común.
6 Estos términos no son sinónimos. Las pinturas epóxicas, vinílicas y acrílicas (entre otras) son químicamente diferentes, pero todas forman estructuras muy grandes que incorporan las moléculas del colorante y otros elementos que llevan las pinturas automotrices. Es decir, todas forman polímeros, pero los monómeros son distintos.
