If by fire of sooty coal th’ empiric alchymist
Can turn, or holds it possible to turn,
Metals of drossiest ore to perfect gold.
John Milton, Paradise Lost (1674)
El hombre estudia su naturaleza para modificarla en beneficio de su supervivencia. En la Edad Media los alquimistas enfocaron sus conocimientos empíricos en encontrar la “fuente de la vida eterna”. Hoy en día, a estos apasionados los conocemos con otro nombre, Neurocientíficos. El delirio por extender la vida del ser humano se ha visto satisfecho con el paso del tiempo gracias a los avances biomédicos. La esperanza de vida que tenemos en la actualidad es al menos el doble comparada con la esperanza de vida de los habitantes de la época medieval. Sin embargo, la prolongación forzada de nuestra vida pagó un precio: la aparición de las enfermedades neurodegenerativas.
De acuerdo con el Fondo de Población de la ONU, existen aproximadamente 800 millones de personas mayores de 60 años, de las cuales 10 millones se encuentran en México. Las enfermedades que tienen mayor prevalencia son Alzheimer y Parkinson, y la complejidad de su tratamiento radica en que conllevan a una irreversible muerte celular. Las terapias celulares con células reprogramadas in vitro constituyen una alternativa eficaz a los trasplantes de tejidos obtenidos de donadores (trasplante alogénico), dado que la probabilidad de rechazo inmune es nula cuando un paciente recibe sus propias células (trasplante autólogo), pero modificadas. Así como los alquimistas buscaban la transmutación del plomo en oro por sus generosas propiedades físicas, la reprogramación celular se refiere al cambio en la expresión genética que permite que un tipo de célula se transforme en un tipo distinto.
Cuanto mayor es el grado de madurez y especialización de una célula, menor es su capacidad regenerativa. Es de esperarse, entonces, que nuestro cerebro no se regenere fácilmente, a diferencia de las células cutáneas, por ejemplo. La presencia de células madre (aquellas que no están especializadas y tienen la capacidad de diferenciarse en muchos tipos celulares) ha sido descrita principalmente en bulbo olfatorio e hipocampo. A pesar de ello, su baja proliferación imposibilita el reemplazo de un tejido dañado. Para obtener el deseado “oro biológico”, es necesario diseñar terapias que permitan regenerar un tejido con células capaces de integrarse a su nuevo microambiente.
Primeros estudios en reprogramación celular:
neuronas a la carta
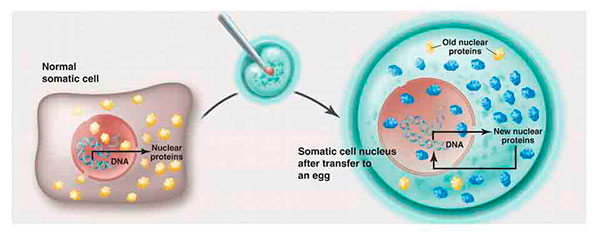
En 2012 los doctores Gurdon en Cambridge y Yamanaka en Kyoto recibieron el Premio Nobel por “el descubrimiento de que las células maduras pueden ser reprogramadas para llegar a ser pluripotentes…”. A partir de sus descubrimientos, la piedra filosofal tenía ahora nombre y apellido. Gurdon demostró que una célula diferenciada conserva en su genoma las instrucciones necesarias para transformarse en cualquier otra. Es decir, una neurona transmisora de señales electroquímicas contiene en su núcleo los genes requeridos para ser una célula cardiaca que se contrae 70 veces por minuto; la diferencia es que en la neurona estos genes están silenciados, pero no irreversiblemente. Si se trasplanta el núcleo de una célula diferenciada en un óvulo que carece de él, la expresión de los genes en la nueva célula seguirá las instrucciones de la primera (ver figura). Entonces el genoma no es el que dicta la decisión final de una célula, sino aquellos procesos químicos que modifican la actividad del ADN sin alterar su secuencia.
Los factores de transcripción son proteínas que regulan la expresión o represión de un gen. Yamanaka combinó 24 de ellos en las células adultas de la piel, con el objetivo de crear células embrionarias pluripotentes in vitro. El resultado impresionante fue que la combinación de solo cuatro es suficiente, Oct4, Sox2, Klf4 y c-Myc. Las células fueron nombradas iPS, células madre pluripotentes inducidas. Esta tecnología ha sido reproducida en todo el mundo y aplicada en la obtención de muchas células diferenciadas, sin que el género, la raza, la edad o la predisposición genética del paciente sean limitantes.
La pregunta surgió inevitablemente: ¿cómo estimular la generación de neuronas a partir de una iPS? Diversos grupos demostraron que al añadir estímulos en el medio de cultivo, por ejemplo ácido retinoico o ácido valproico, las iPS se convertían en alguno de los tipos neuronales. Para confirmarlo además molecularmente, se usaron los marcadores de precursores neuronales (iNSCs) Sox1 y Pax6. Los experimentos fueron extrapolados a ensayos clínicos con pacientes neurológicos, y se han reportado resultados prometedores en el tratamiento de Alzheimer, Parkinson, Huntington, esclerosis lateral, atrofia muscular y esquizofrenia.
Retos para una neurona Jedi
(el lado no oscuro de la fuerza epigenética)
Las neuronas poseen características únicas en nuestro organismo; durante el desarrollo embrionario, no menos de mil subtipos diferentes de neuronas aparecen: algunas con largos axones o extensas ramificaciones dendríticas. La regulación de sus procesos fisiológicos es, pues, compleja y altamente regulada. Las células obtenidas in vitro son heterogéneas con distintos grados de diferenciación. Uno de los retos más importantes es evitar que la célula madre diferenciada en cultivo prolifere indefinidamente y cause tumores. Además, los factores de transcripción se han añadido hasta ahora por medio de agentes virales, pero es necesario establecer mejores vías de administración. Un aporte interesante sugiere transfectar ARN mensajero en vez de las secuencias codificantes para los factores de transcripción, ya que se obtienen precursores neuronales en un menos días que con virus, y es una técnica inocua para el genoma de la célula huésped.
¿Qué papel juegan los mecanismos epigenéticos? Las modificaciones más comúnmente estudiadas son remodelación de la cromatina, metilación (represión por cierre) y acetilación (activación por apertura) del ADN. Recientes estudios proponen a los microARNs (miARNs, pequeñas secuencias de ARN de 22-25 nucleótidos, que bloquean el ARN mensajero para la producción de proteínas) como reguladores epigenéticos con una participación crucial en la regulación de las células madre neuronales. Por ejemplo, miR-9 miR-124 son capaces también de inducir reprogramación de fibroblastos hacia neuronas en estado adulto, de una manera inclusive más efectiva que con la combinación de los factores de transcripción. Por si fuera poco, la migración de éstas hasta los sitios de lesión ha sido eficiente en un modelo murino de infarto cerebral.
Los alcances que la reprogramación puede tener en el futuro incluyen trasplante de neuronas en pacientes con daño tisular después de infarto cerebral, terapia de reemplazo celular en enfermedades con alteraciones genéticas congénitas, como neuromiopatías, estudio de modelos de enfermedades humanas cuyo origen genético se desconoce, estudio del desarrollo embrionario de los tejidos humanos y síntesis de nuevos fármacos. Como estudiantes de las áreas de investigación biomédica, es un privilegio poder presenciar los avances agigantados en cuanto al conocimiento de la función de una célula, y su complejidad. Kazaam…¡en neurona te convertirás!.
Bibliografía
- Gage, F. y Temple, S., (2013). Neuron 80, 588-601.
- Gurdon J. B., (2003). Oncol. Res., 13(6-10):301.
- Imaizumi, Y.; Okano, H, (2014). J. Neurochem. 129, 388-399.
- Kim, J. et. al., (2011). Proc. Natl. Acad. Sci. 10;108(19):7838-43.
- Ruggieri M.; et. al., (2013). Prog. Neurobiol. 114, 15-24.
- Takahashi, K. y Yamanaka, S., (2006). Cell 126(4):663-676.
- Warren L. et . al. (2010). Cell Stem Cell 5;7(5):618-30.
- Zhu W. et.al., (2008). Stroke 39(4):1254-61.
Twittear