La terapia fotodinámica (TFD) ha experimentado un desarrollo desde la década de 1970, coincidiendo con la invención del láser y su aplicación médica. Aunque sus fundamentos se remontan a la antigüedad, el término “efecto fotodinámico” fue acuñado en el año de 1904 al estudiar la toxicidad del compuesto acridina sobre organismos unicelulares por parte de Hermann Von Tappeiner y Oscar Rabb. Demostraron que la toxicidad de la acridina era más efectiva en función de la hora del día debido a que las muestras se mantenían cerca de una ventana por la que ingresaba la luz.
En 1905 se aplicó por primera vez la TFD por Tappeiner en el tratamiento de cáncer de piel mediante aplicación tópica de eosina al 1 por ciento e irradiación con luz blanca.
Actualmente su uso no se restringe al tratamiento de cáncer sino también distintas enfermedades de la piel como acné, queratosis actínicas y algunos tipos de infecciones microbianas (terapia fotodinámica antimicrobiana = TFDA).
La TFD requiere de tres componentes esenciales para funcionar correctamente: un fotosensibilizador (una molécula que absorbe la luz), una longitud de onda adecuada y el oxígeno intracelular. Esta técnica se basa en la administración de un fotosensibilizador, que se acumula selectivamente en algunas células debido a su afinidad por ciertos componentes celulares, una vez que el fotosensibilizador se ha acumulado en las células objetivo, se activa mediante la luz, provocando la producción de especies reactivas de oxígeno induciendo su muerte celular, permitiendo un tratamiento efectivo y mínimamente invasivo de distintos tipos de enfermedades de la piel.
La TFD es una técnica con un enfoque prometedor para combatir las infecciones bacterianas y fúngicas, ya que puede inactivar eficazmente microorganismos, tanto en forma planctónica como en biopelículas. Sin embargo, la mayoría de los estudios se han centrado en el efecto general en millones de células, en lugar de la respuesta individual de cada una. Esto limita nuestra comprensión de los mecanismos fundamentales y la posible variabilidad en la eficacia del tratamiento en diferentes células. Por lo tanto, se requiere una investigación más detallada para explorar los efectos a nivel celular y optimizar su aplicación clínica.
El uso de trampas ópticas puede ser una herramienta útil en esta investigación, ya que permitiría la manipulación precisa de células individuales y el monitoreo de los cambios en tiempo real. Fueron desarrolladas por el fallecido científico estadounidense Arthur Ashkin, galardonado con el Premio Nobel de Física en 2018, y permiten confinar y manipular objetos microscópicos. El principio físico de funcionamiento de las pinzas ópticas es la fuerza óptica que se produce cuando un rayo de luz interactúa con un objetivo de microscopio. Esta fuerza se debe a la transferencia de momento del haz de luz a las partículas y se produce cuando la luz se enfoca fuertemente usando objetivos de microscopios 100x, creando una región de alta intensidad en la cual se produce el atrapamiento óptico i. e., en el foco de la lente.
En la región de máxima intensidad, la luz interactúa con el objeto y genera una fuerza que tira del objeto hacia el foco. Esta fuerza es proporcional al gradiente de intensidad de la luz y al índice de refracción del medio que rodea al objeto, lo que permite una manipulación precisa de partículas.
Las pinzas ópticas no solo son efectivas con material inanimado, sino también han demostrado ser una técnica eficaz para manipular células vivas, lo que ha llevado al desarrollo de nuevas técnicas para la terapia celular y la ingeniería de tejidos. Esto ha abierto un amplio espectro de posibilidades para la investigación en este campo.
En el laboratorio del grupo de biofotónica del Instituto Nacional de Astrofísica, Óptica y Electrónica se han realizado varios estudios haciendo uso de esta técnica y se ha demostrado la capacidad de las pinzas ópticas para manipular células vivas y su posible uso en terapia celular.
En uno de los experimentos se estudió el efecto de la TFDA en una sola célula. Se utilizó un sistema de pinzas ópticas (OT) (Elliot Scientific®) equipado con un objetivo de microscopio con una apertura numérica de 1.45, y un láser infrarrojo de onda continua con una longitud de onda de 1070 nm.
Para la aplicación de la terapia se utilizaron células de C. tropicalis en un medio de caldo de dextrosa Sabouraud (SBD). Las muestras se incubaron con azul de metileno a una concentración de 10µM como fotosensibilizador durante 30 minutos, posteriormente se aplica luz roja con una dosis de 60 J/cm2. Las células tratadas se depositaron en una cámara que consta de dos placas de vidrio separadas por 120 m y colocadas en el sistema OT (Figura 1). Un orgánelo dentro de la célula fue atrapado ópticamente y la posición, además de la fuerza de captura, se midieron utilizando un fotodiodo detector de cuadrante (QPD, por sus siglas en inglés).
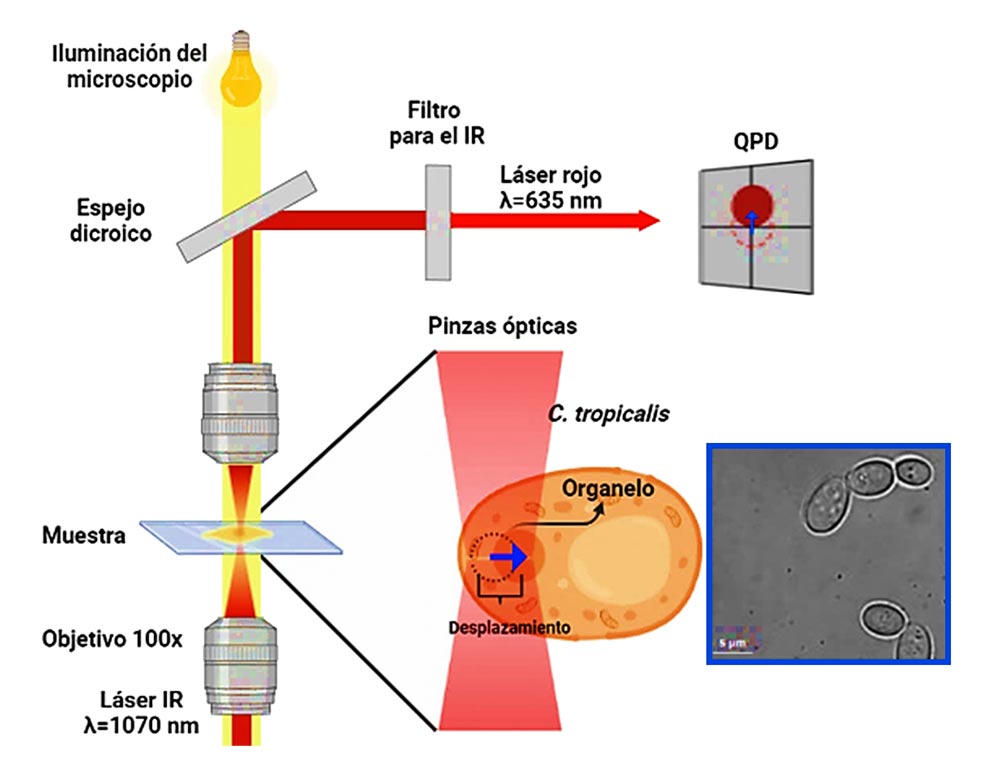
Figura 1. Diagrama del atrapamiento óptico para un orga- nelo de C. tropicalis con el uso de pinzas ópticas y vista de las levaduras al microscopio con 100 x (recuadro azul).
Los resultados preliminares indican un incremento en la rigidez de la trampa que concuerda con el aumento en la viscosidad intracelular después de la aplicación de TFDA, proporcionando una herramienta para la caracterización mecánica durante la muerte celular.
Este avance en la tecnología de las pinzas ópticas tiene el potencial de mejorar significativamente el tratamiento de diversas enfermedades en el futuro, especialmente en el campo de la terapia celular. Además, esta técnica tiene implicaciones en el estudio de la física y mecánica celular que pueden ayudar a comprender mejor los distintos procesos biológicos.
* [email protected], [email protected], [email protected]
Referencias
- Dougherty, T. J., Gomer, C. J., Henderson, B. W., Jori, G., Kessel, D., Korbelik, M., … & Peng, Q. (1998). Photodynamic therapy. JNCI: Journal of the national cancer institute, 90(12), 889-905.
- dos Santos, A. F., De Almeida, D. R. Q., Terra, L. F., Baptista, M. S., & Labriola, L. (2019). Photodynamic therapy in cancer treatment-an update review. Journal of cancer metastasis and treatment, 5, 25.
- Jan Gieseler, Juan Ruben Gomez-Solano, Alessandro Magazzù, Isaac Pérez Castillo, Laura Pérez García, Marta Gironella-Torrent, Xavier Viader-Godoy, Felix Ritort, Giuseppe Pesce, Alejandro V. Arzola, Karen Volke-Sepúlveda, and Giovanni Volpe, “Optical tweezers — from calibration to applications: a tutorial,” Adv. Opt. Photon. 13, 74-241 (2021)
- Pesce, G., Jones, P. H., Maragò, O. M., & Volpe, G. (2020). Optical tweezers: theory and practice. The European Physical Journal Plus, 135, 1-38.